Activités associées :
#Matière 1 : Les atomes
- ont un symbole chimique : F,O, Cu, Ag ... (Première lettre en majuscule, deuxième et troisième en minuscule)
- peuvent se lier en molécules, notées à l'aide d'une formule chimique : CO2 pour le dioxyde de carbone (1 atome de Carbone et 2 d'Oxygène) par exemple.
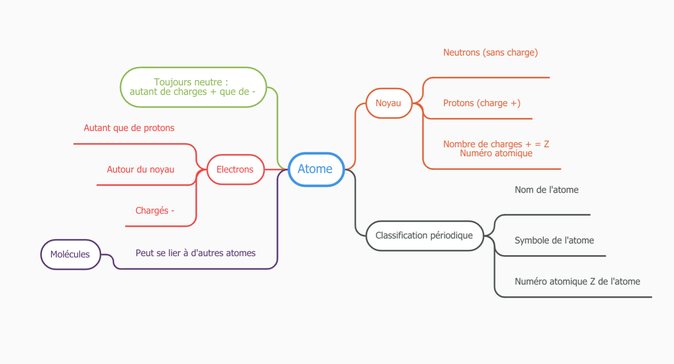
- sont formés de protons (charge positive), de neutrons (charge nulle), qui forment le noyau (on les appelle les nucléons) et d'électrons (charge négative) en mouvement autour du noyau.
- sont neutres : ils sont constitués d'autant de protons que d'électrons.
- sont classés par leur numéro atomique Z dans la classification périodique des éléments : c'est leur nombre de protons.
Remarque : le nombre de neutrons peut varier pour un même atome, on peut le calculer en faisant A-Z avec A nombre de nucléons de l'atome.
Exercices : 10 - 17 pages 52 et 53
Activités associées :
#Matière 2 : La masse volumique
- est une propriété caractéristique d'un corps.
- se calcule avec cette formule ρ = m / V , avec ρ la masse volumique en kg/m3 , m la masse du corps en kg et V le volume du corps en m3
- a pour unité le kilogramme par mètre cube (kg/m3). Elle est parfois exprimée en kg/L, en g/mL, g/cm3
- permet de calculer une masse avec la formule modifiée m = ρ × V
- permet de calculer un volume avec la formule modifiée V = m / ρ
Exercice : problème page 109
Activités associées :
#Matière 3 : Pollutions liées au numérique
- La principale source de pollution vient de la fabrication des composants des appareils numériques notamment à cause des terres rares qu'il faut extraire du sol.
- La deuxième vient de la production d'énergie électrique pour alimenter les réseaux, serveurs et antennes... surtout si on utilise une source d'énergie fossile, qui en brûlant va notamment produire du dioxyde de carbone (CO2), gaz à effet de serre, l'un des responsables du déréglement climatique.
- Cette estimation des conséquences sur l'environnement d'un geste (utilisation d'un véhicule, fabrication d'un objet...) s'appelle l'empreinte (ou bilan) carbone.

Activités associées :
#Matière 4 : les ions
- Un ion est un atome ou un groupe d'atomes qui a perdu ou gagné un ou plusieurs électrons.
- Le gain d'un ou plusieurs électrons donne un ion négatif : un anion
- La perte d'un ou plusieurs électrons donne un ion positif : un cation
Exemples :
- l'atome de fluor F gagne un électron pour devenir l'ion fluorure F-
- l'atome de cuivre Cu perd deux électrons pour devenir l'ion cuivre Cu2+
Exercices : 14 page 70 (5 min) et 26 p 72 (15 min)
Activités associées :
#Matière 5 : Tests de reconnaissance des ions
- La présence d'ions peut être établie à l'aide de tests par précipitation.
- Un précipité (poudre en suspension) apparaît lorsque le test est positif.
- L'hydroxyde de sodium (la soude) permet de tester la présence de plusieurs ions métalliques (cuivre, fer...).
- Le nitrate d'argent permet de tester la présence des ions chlorure.
Exercices : 16 page 70 (5 min)
Activités associées :
#Matière 6 : pH et ions
- Le pH d’une solution aqueuse permet de savoir si une solution est acide, neutre ou basique.
- Le pH d’une boisson se mesure à l’aide d’un papier indicateur de pH ou avec un appareil appelé pH-mètre.
- Toutes les solutions aqueuses contiennent des molécules d’eau, des ions hydrogène H+ et des ions hydroxyde OH-.
- Une solution dont le pH est égal à 7 (neutre) contient autant d’ions H+ que d’ions OH-.
- Une solution acide, comme l’acide chlorhydrique (H+,
Cl-) , a un pH inférieur à 7 car elle
contient davantage d’ions H+ que d’ions OH-.
Ce sont les ions H+ qui sont responsables de l’acidité. - Une solution basique, comme la soude (Na+, OH-), a
un pH supérieur à 7 car elle contient davantage d’ions OH- que d’ions H+.
Ce sont les ions OH- qui sont responsables de la basicité.
Exercices : 19 page 70 et 17 page 70
Activités associées :
#Matière 7: Réaction entre acide et fer
- Le contact entre un acide et le fer déclenche une transformation chimique : deux nouveaux corps apparaissent, le gaz dihydrogène H2 et l'ion ferreux Fe2+ (qui s'écrit aussi ions Fer II).
- Le bilan de la réaction est donc : acide + fer →dihydrogène + ion fer II
- La réaction qui modélise la transformation a pour équation : 2 H+ + Fe → H2 + Fe2+
- Cette réaction est équilibrée à la fois en terme d'atomes, mais aussi en terme de charges.
Exercices : 6 page 86 et 13 page 87
Ce site a été conçu avec Jimdo. Inscrivez-vous gratuitement sur https://fr.jimdo.com